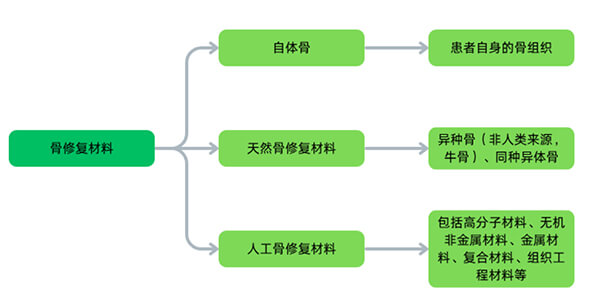
在全球每年220万例骨移植手术中,大体积骨缺损修复仍面临重大挑战。目前,骨修复材料主要分为三类:自体骨、天然骨修复材料以及人工骨替代材料。其中,自体骨移植受限于供体短缺和二次创伤,而异体骨和金属植入体存在免疫排斥和力学适配问题。
可降解聚酯材料(PLA/PLGA/PCL等)通过3D打印等先进技术可精准构建仿生多孔支架,其可控降解特性、优异生物相容性和可调力学性能,为骨再生提供了突破性解决方案,尤其适用于创伤或肿瘤切除后的临界尺寸骨缺损修复。
可降解聚酯具备:
✅ 良好的生物可降解性与体内代谢路径;
✅ 优异的成型加工性能,尤其适配3D打印与定制设计;
✅ 降解周期可控调节,能够良好匹配骨愈合过程
然而,为了增强聚酯支架的力学性能与成骨活性,研究者常将其与无机陶瓷(如羟基磷灰石、磷酸三钙)进行复合。尤其是纳米羟基磷灰石(nHAp)作为模拟天然骨矿物成分的无机材料,具备极强的成骨诱导性和药物缓释能力。在复杂颌面骨缺损等模型中,聚酯及其复合支架已表现出优异的骨整合能力与力学支撑效果。
那么,如何通过结构优化与功能集成,让可降解聚酯材料在骨修复中发挥更大作用?
一、从结构到功能:支架设计核心逻辑
骨再生不仅仅是空间填补,更是一场涉及结构力学—细胞行为—组织微环境多维度协调的系统工程。聚酯支架的设计从静态“形似”向动态“功能性”转变,主要涉及三个关键方面:
1. 微结构设计:孔径、孔隙率、连通性
孔结构是支架生物性能的基础。
✅最佳孔径范围:300–500μm,可促进骨组织长入、血管生成和营养渗透;
✅孔隙率推荐值:70–90%,过高可能导致支架力学性能下降;
✅结构梯度设计:如咀嚼负重区域(如下颌骨外侧)适合较小孔径以增强支撑力,而窦底等受力较小区域可采用大孔设计以利于细胞浸润。
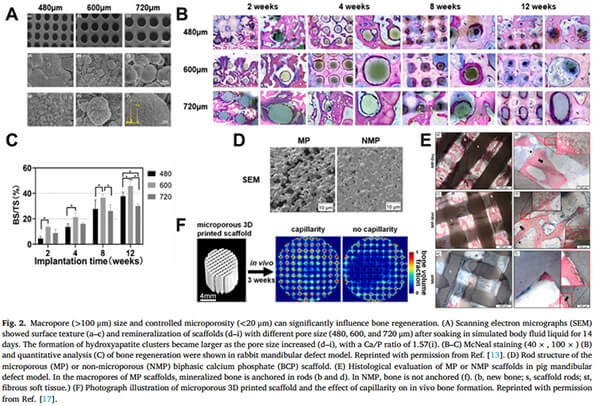
研究报道,600μm甚至1000μm的大孔径支架在特定解剖位置可实现更优的骨形成效果。(A)扫描电子显微镜(SEM)显示具有不同孔径的支架的表面纹理和再矿化,随着孔径的增大,羟基磷灰石团簇的形成量增大。(B-C)McNeal染色(40 ×,100 ×)(B)和定量分析(C)在兔下颌骨缺损模型中显示骨再生。(D)微孔(MP)或非微孔(NMP)双相磷酸钙(BCP)支架的杆结构。(E)在猪下颌骨缺损模型中MP或NMP支架的组织学评价。在MP支架的大孔中,矿化骨锚定在杆中(B和d)。在NMP中,骨不锚定(F)微孔3D打印支架的照片说明和毛细作用对体内骨形成的影响[1]。
2. 降解动力学与骨愈合协同
材料的降解速率应与组织修复节奏相匹配,做到“适时消失”:
·PLGA 降解周期可通过调控乳酸/羟基乙酸比例实现;
·陶瓷组分如TCP在降解中释放Ca²⁺/PO₄³⁻,可直接激活成骨信号;
·速降解可能导致结构坍塌,慢降解则可能阻碍新骨整合。
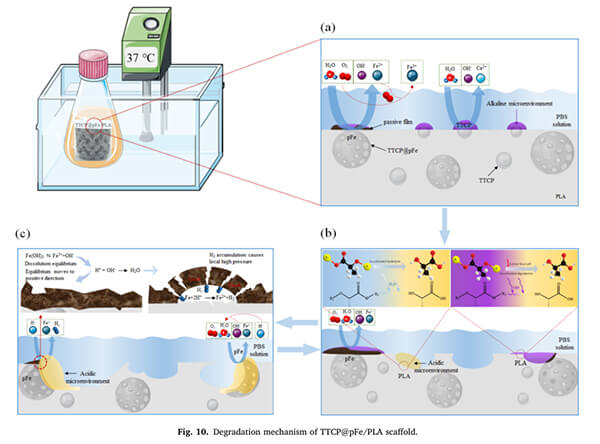
研究报道,制备的PLA复合磷酸四钙(TTCP)和多孔铁(pFe)支架(TTCP@ pFe/PLA),TTCP溶解产生的碱性环境可以有效催化PLA的水解,加速其降解[2]。
3. 力学适应性设计
良好的力学适配不仅能提升早期稳定性,更有助于成骨:
· 聚酯复合支架弹性模量应匹配不同部位的骨密度;
· 在高剪切力区域(如下颌咀嚼区),刚性+韧性平衡尤为关键;
· 多孔结构设计必须兼顾力学强度与功能孔道配置。
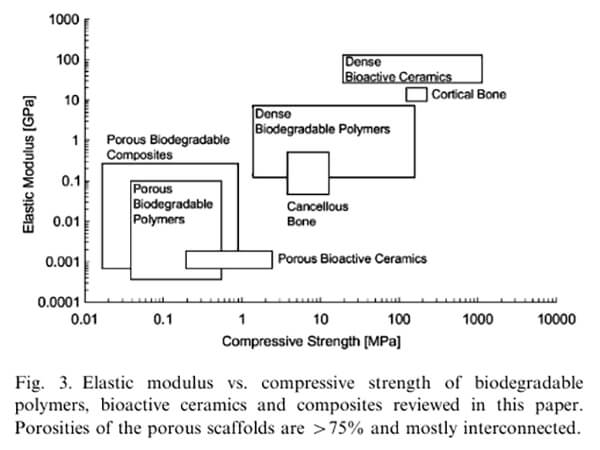
一般来说,人体的支架承受压应力,压缩模量应介于小梁骨(0.01-2.0 GPa)和皮质骨(8-25 GPa)之间。支架的性能可以根据骨损伤不同植入部位所需的抗压强度在此范围内进行调整,一些致密聚合物的性能与松质骨相当,且接近皮质骨的性能[3]。
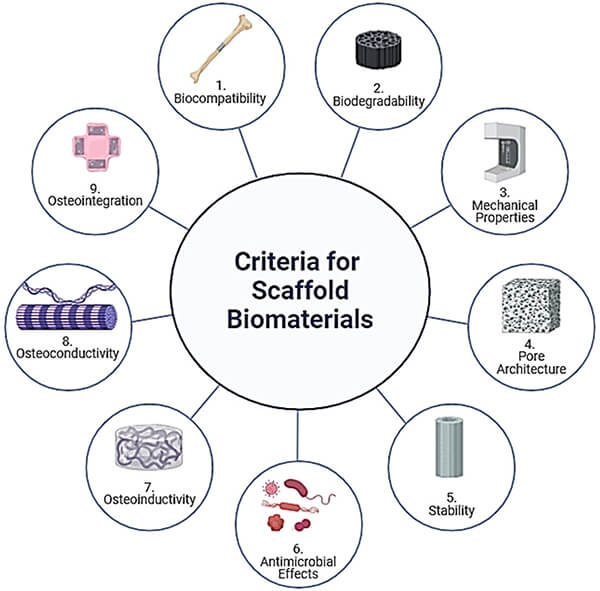
支架制造过程中期望获得的性能[4]。
二、智能响应:支架进阶逻辑
当前,研究者正探索具备“环境感知能力”的智能支架,让其从被动材料转变为微环境调控器。主要发展方向包括:
1. 外部刺激响应
外部物理刺激包括光、磁、电、超声、力学负载等,能够精确触发支架内部功能模块,实现以下效果:
· 光热响应(如PLGA+黑磷纳米片),在近红外照射下释放热能并上调成骨相关蛋白;
· 磁热响应(如Fe₃O₄/PLGA复合支架),磁场刺激下产生局部升温,有助于骨肿瘤消融并促进成骨;
· 电刺激响应(如掺杂导电聚合物PPy的聚酯支架),激活钙离子信号通路,增强成骨相关基因表达;
· 超声响应:低频超声可触发支架释放生长因子或抗菌因子,用于深部组织治疗。
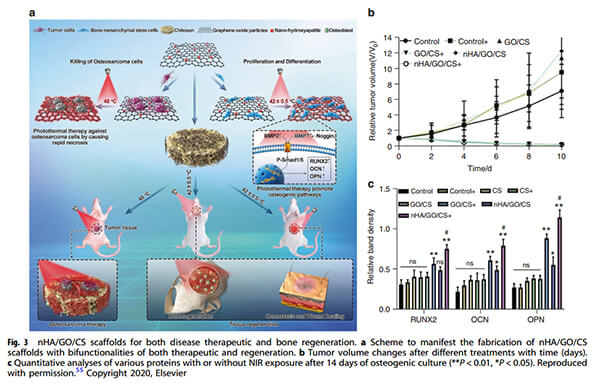
用于疾病治疗和骨再生的nHA/GO/CS支架。(a)显示具有治疗和再生双重功能的nHA/GO/CS支架的制造的方案。(b)不同治疗后肿瘤体积随时间(天)的变化。(c)成骨培养14天后,在有或没有NIR暴露的情况下对各种蛋白质的定量分析[5]。
2. 内源微环境响应
· ROS过表达:响应释放抗氧化剂或骨诱导因子;
· pH响应系统:感知炎症/感染酸化,自动调节降解与药物释放;
· 负载因子控释:内嵌BMP-2、VEGF、抗菌肽,实现分时程成骨与抗感染;
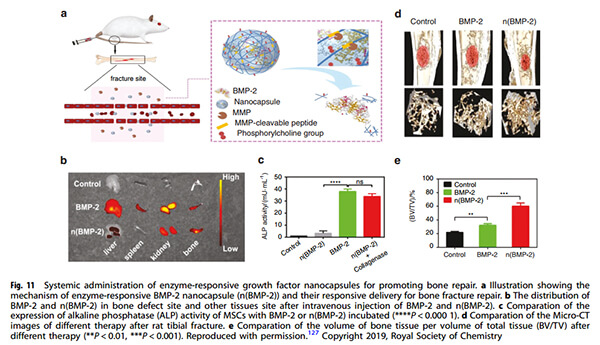
酶响应性BMP-2纳米胶囊(n(BMP-2))的机制及其用于骨折修复的响应性递送。静脉注射BMP-2后在骨缺损部位和其他组织部位的分布。用BMP-2孵育的MSC的碱性磷酸酶(ALP)活性的表达的比较。大鼠胫骨骨折后不同治疗方法的Micro-CT图像比较。每单位总组织体积的骨组织体积(BV/TV)比较[5]。
3. 结构调控
· 免疫调控结构:调节巨噬细胞极化态(M1→M2),实现“抗炎-成骨”联动;
· 仿生分层支架:模拟骨皮质-松质结构,增强细胞黏附与空间分化。
Liu等使用PLLA构建的微纤维支架将将更多的RAW264.7细胞极化到选择性激活的巨噬细胞 (M2)在修复大鼠颅骨缺损的体内实验中加速了新骨的形成[6]。
这些复合与响应策略,正在逐步从实验室走向大动物模型与临床探索,代表了BTE支架材料的发展趋势。聚酯材料因其优异的加工性和复合适应性,成为承载这些功能单元的理想“基体”。
三、可降解医用聚酯材料解决方案
深圳聚生专注于医用单体、可降解聚酯(包括PLA、PCL、PGA及其共聚物)、聚酯微球、聚酯基复合材料、FDM 3D打印线材及SLS 3D打印粉末,同时提供高精度成型加工服务,能够满足各类植入级可吸收医疗器械的开发与应用要求。
随着4D打印、AI结构建模、生物信息学模拟等技术的引入,聚酯复合支架正逐步迈向功能集成化、应用个性化、制造可控化的“系统材料”时代。
结语:聚酯为基,复合为翼,骨再生的未来可塑
骨修复不只是材料科学的问题,更是一个系统性调控工程。可降解聚酯为骨再生提供了结构基础与可调节的代谢过程,而与生物陶瓷、药物、细胞因子等的复合,则为其插上了“功能的翅膀”。
下一代聚酯支架,将不只是“可降解”,而是真正“可引导、可调节、可自适应”的生物材料系统,助力我们迈向个性化、智能化的再生医学新时代。
参考文献推荐:
1.Huang, Xiangya, et al. “Biomaterial scaffolds in maxillofacial bone tissue engineering: A review of recent advances.”Bioactive Materials, vol. 33, 2024, pp. 129-156.
2.Zhu,Shunshun,et al."Research Progress in 3D Printed Biobased and Biodegradable Polyester/Ceramic Composite Materials: Applications and Challenges in Bone Tissue Engineering." ACS Applied Materials & Interfaces, vol. 17, no. 1, 2025, pp. 2791-2813.
3.Rezwan, K., et al. "Biodegradable and Bioactive Porous Polymer/Inorganic Composite Scaffolds for Bone Tissue Engineering." Biomaterials, vol. 27, no. 18, 2006, pp. 3413-3431.
4.Percival, Kelly M, et al. “Recent Advancements in Bone Tissue Engineering: Integrating Smart Scaffold Technologies and Bio-Responsive Systems for Enhanced Regeneration.”International Journal of Molecular Sciences, vol. 25, no. 11, 2024, p. 6012.
5.Wei, Hongpu, et al. "Recent Advances in Smart Stimuli-Responsive Biomaterials for Bone Therapeutics and Regeneration." Bone Research, vol. 10, 2022, p. 17.
6.Liu, Xingzhi, et al. "Immunopolarization-regulated 3D printed-electrospun fibrous scaffolds for bone regeneration." Biomaterials, vol. 276, 2021, p. 121037.

