一、背景介绍
近年来,生物降解高分子与增材制造技术在骨组织工程领域备受关注。聚乳酸(PLA)及其共聚物材料作为一种生物相容性好、降解产物安全的热塑性聚合物,已被广泛应用于组织修复。尤其与磷酸无机材料(如羟基磷灰石、β-磷酸三钙)复合,可显著提高成骨活性和力学性能。另一方面,选择性激光烧结(SLS)技术能够逐层烧结粉末,制造形状复杂、孔道互联的支架结构。该技术已被用于钛合金和PEKK等植入物生产,但两者在人体内难以降解,存在长期并发症风险。因此,结合可降解聚酯材及复合材料料与SLS 3D打印技术,以实现“降解+个性化定制“骨修复支架成为研究热点。相关文献报道[1-3],通过SLS工艺制备的PLA/无机复合材料支架,在体外可诱导干细胞成骨分化,展现优异的生物活性,为骨缺损修复提供了新的思路。
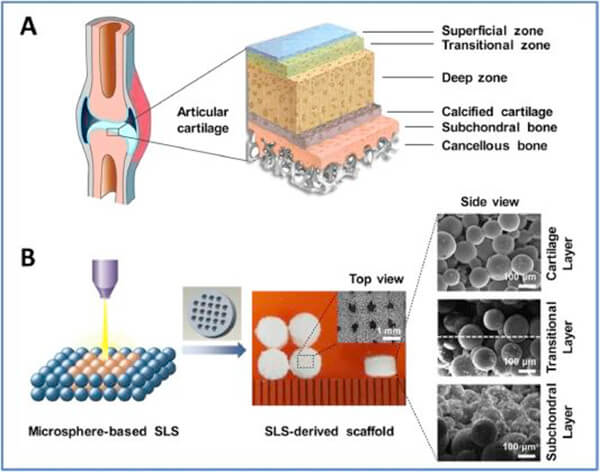
图1.天然骨软骨(上)及牙槽骨修复 (下)
二、SLS是什么?
SLS是一种粉末床熔融类增材制造技术,通过高功率激光束选择性地烧结粉末材料层层堆叠成型。它不依赖模具,打印路径由数字模型精确控制,非常适合定制化医疗器械的快速制造。操控激光能量和扫描算法,可控制成型件致密度与微孔率。并且与传统FDM不同,SLS无需支撑结构,适合制作结构复杂、高孔隙率及多层次梯度的结构类型。
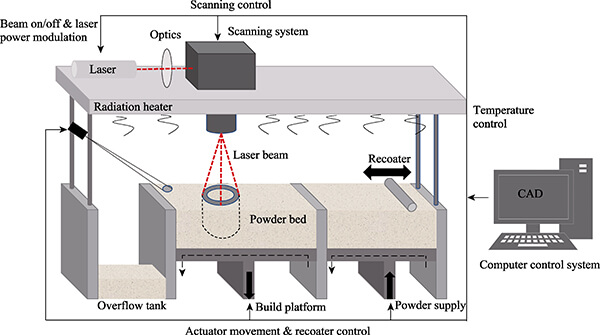
图2. SLS打印原理示意图
三、SLS打印粉末的基本特性及制备方式
选择性激光烧结(SLS)对粉末的要求十分严格,主要包括适中的粒径范围(一般为20–100 μm)与窄粒径分布,以保证铺粉均匀与成型精度;粉末需具备良好的流动性和较高的堆积密度,以提高打印效率和致密度;热性能稳定,需具备合适的熔点、玻璃化转变温度和热分解温度,确保激光烧结过程稳定可靠;此外,粉末还需具备良好的激光吸收能力、形貌接近球形、储存稳定性强,并具备较好的重复使用性能。这些特性共同决定了粉末在SLS工艺中的可打印性和最终成型质量。
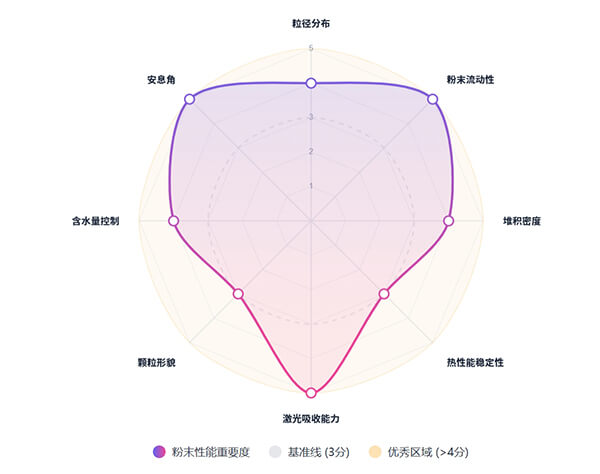
图3. SLS打印粉末的关键因素
以下是高分子粉末制备常用技术,各有特点:机械粉碎法经济实用,但粉末形状不规则、流动性较差;球磨法所得粉末规整性与流动性佳,却操作复杂、效率低。溶剂沉淀法通过溶解-析出获得粉末;诱导成球法可制备高球形度颗粒。乳液挥发法工艺温和、粒径可控,适用于热敏性物质,但存在乳化复杂、溶剂残留、产量低等问题;聚合法能合成粒径均匀、球形度高的微球,只是微球粒径偏小。
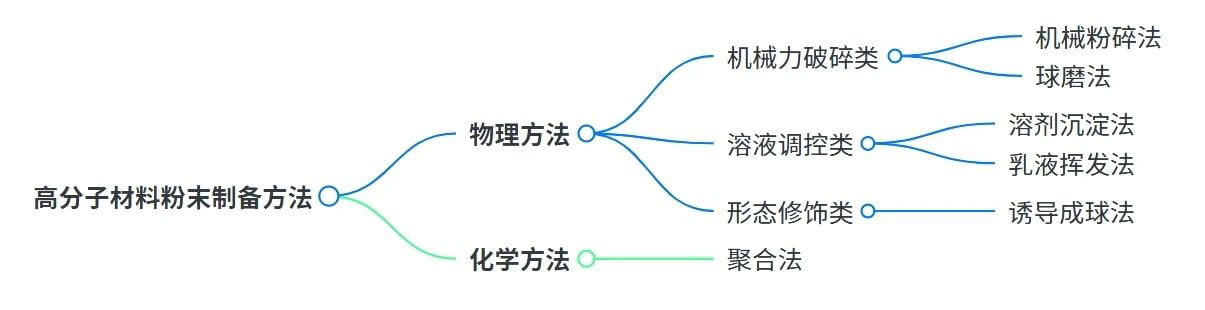
图4. 聚合物粉末制备常用方法
四、应用研究
选择性激光烧结(SLS)技术与可降解聚酯(如PLA、PCL、PGA及其共聚物)的结合,在骨修复领域展现出独特且显著的应用价值,其通过精准调控材料组成、梯度结构及孔隙特征,既能借助聚酯的可降解性匹配骨组织再生周期,又能结合生物活性填料(如HA、HAP、β-磷酸三钙等)提升成骨诱导能力,同时利用SLS的工艺优势实现支架力学性能与生物相容性的协同优化,为骨缺损修复提供了高效、定制化的解决方案。

图5.(a)深圳聚生开发用于SLS 3D打印的可降解聚酯粉末;(b)SLS 3D打印的拉伸样条;(c)SLS 3D打印的组织支架。
案例一:多层PCL/HA梯度支架
Du等[1]构建了基于SLS的仿生多层PCL/HA梯度支架,用于兔膝关节软骨缺损修复。研究人员设计了一款4 mm直径、2.8 mm高的圆柱形支架,孔径500 μm,共七层,每层HA含量自顶向底连续增高(0→30%),顶层为厚400 μm纯PCL。实测结果显示,该支架孔隙率约60.3%,压缩模量8.7 MPa、抗压强度4.6 MPa。体外培养发现,该多层支架可良好支持兔间充质干细胞黏附,7天时细胞增殖量显著高于纯PCL支架,提高了生物活性;20–30% HA层的支架显著提升了干细胞ALP活性,提示成骨分化被促进。
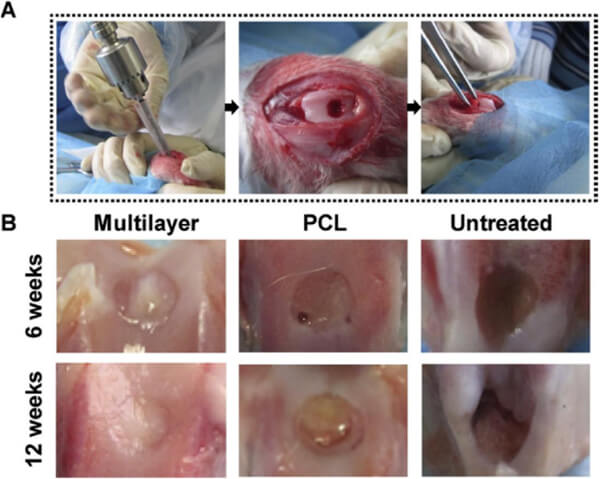
图6. SLS软骨支架的体内评估。(A)创建兔子骨软骨缺损模型的外科手术,使用骨科钻头制造缺损,然后植入不同的支架;(B)植入后 6 周和 12 周的宏观观察显示,多层支架中的软骨修复优于 PCL 支架和未治疗的对照;在第 12 周,多层显示软骨样组织,外观与周围的天然软骨相似。
案例二:PLA/HAP微球与SLS打印
Dong等[2]采用乳液溶剂挥发法制备了聚乳酸(PLA)和羟基磷灰石(HAP)复合微球。制备过程中,通过调整PVA浓度、油/水比和搅拌速率,可得到粒径约40–60μm的规则圆形微球。HAP在PLA微球内分散均匀,其表面出现多孔结构(HAP的存在引发孔洞形成)。随后利用SLS技术打印微球层状堆积部件,发现以激光功率4–7W烧结,可获得良好的微球熔合质量:功率越高,颗粒间结合越充分。化学分析表明,激光能量输入并未改变PLA/HA复合物的化学成分,表明所得支架在物理化学上稳定。
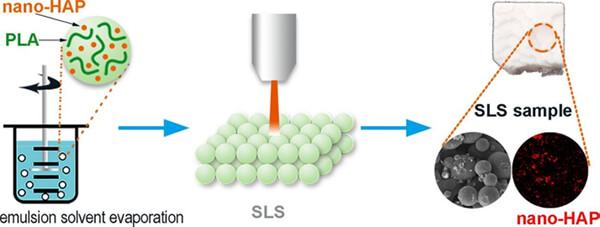
图7. 乳液溶剂蒸发合成了由聚乳酸(PLA)/羟基磷灰石(HAP)复合微球,然后使用激光粉末床烧结(SLS)制造分层零件。
案例三:无溶剂PLA/CaCO₃粉末与SLS
Gayer等[3]研发了一种无溶剂制备的PLA/碳酸钙(CaCO₃)复合粉末,适用于SLS骨支架打印。研究者将聚乳酸(75 wt%)与高纯度蚕砂碳酸钙(25 wt%)一起研磨成微粉,并选择不同固有粘度(IV)的PLA进行比较。结果显示,固有粘度最低(1.0 dl/g)的PLLA能粉碎成最小颗粒(d₅₀≈50 μm),对应熔体粘度低(约400 Pa·s),有利于快速烧结。采用这种PLLA-1.0/CaCO₃(75/25)粉末进行SLS后,在最佳参数(激光功率约0.40 W)下,打印件具有极低的微孔率(≈2%),同时获得了高达75 MPa的双轴弯曲强度。微孔率低意味着成型颗粒几乎完全融合,从而提升了力学性能。
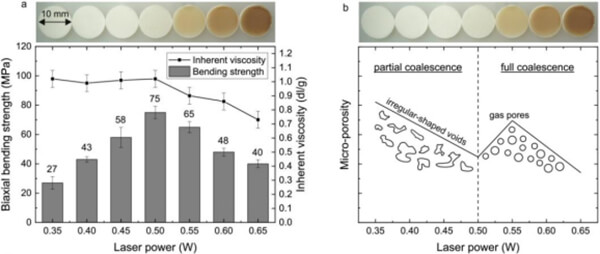
图8. 由基于 PLLA-1.0 的复合材料制造的圆形 SLS 样品(直径 10 mm,厚度为 1 mm)分析:(a) 双轴弯曲强度和固有粘度与激光功率的关系,(b) 微孔隙率的定性行为与激光功率的关系。
五、未来展望
可降解聚酯/无机复合粉末结合SLS增材制造技术在骨修复支架方面的研究与应用向功能化和高精度方向发展:
1.材料体系升级:下一步可引入多种生物陶瓷(如钙磷化合物、玻璃陶瓷)或仿生聚合物(胶原、明胶等)复合可降解聚酯材料,构建更多层次的力学和成骨梯度;同时掺入生长因子或药物,实现支架的生物活性强化;
2.打印精度提升:随着激光器和扫描系统的进步,将实现更细粉末和更精细的激光束控制,使支架结构更加精确稳定,可实现亚百微米级的孔隙及细节特征。新的SLS设备(如双激光、多光束)也将进一步提高成型效率和可靠性;
3. 多功能支架设计:未来支架不再仅提供力学支撑和骨诱导,还将集成药物或细胞递送功能,例如在支架内部加载抗菌药物、骨促生长因子或光热响应粒子;此外,可开发智能可吸收元件,实现动态力学响应和组织适应。
总之,结合最新的材料科学与3D打印工艺,可降解聚酯及其无机复合粉末结合SLS增材制造技术有望制造出结构高度可定制、高精度及功能全面的生物活性骨支架,为临床骨缺损修复带来更多可能。
深圳聚生专注于医用单体、可降解聚酯(包括PLA、PCL、PGA及其共聚物)、聚酯微球、聚酯基复合材料、FDM 3D打印线材,以及满足SLS 3D打印的可降解聚酯粉末及其复合材料粉末,同时提供高精度成型加工服务,能够满足各类植入级可吸收医疗器械的开发与应用要求。
参考文献
[1] Du Y, Liu H, et al. Selective laser sintering scaffold with hierarchical architecture and gradient composition for osteochondral repair in rabbits[J]. Biomaterials, 2017, 137: 37–48. DOI: 10.1016/j.biomaterials.2017.05.021.
[2] Dong Y, Zeng B, et al. Preparation and laser powder bed fusion of composite microspheres consisting of poly(lactic acid) and nano-hydroxyapatite[J].Additive Manufacturing, 2020, 34:101305. DOI: 10.1016/j.addma.2020.101305.
[3]Gayer C,Ritter J,et al.Development of a solvent-free polylactide/calcium carbonate composite for selective laser sintering of bone tissue engineering scaffolds[J]. Materials Science and Engineering:C,2019,101:660–673.DOI: 10.1016/j.msec.2019.03.101.

